根据杂化轨道理论,直线型为()杂化,正四面体型为()杂化。
题目
根据杂化轨道理论,直线型为()杂化,正四面体型为()杂化。
相似考题
更多“根据杂化轨道理论,直线型为()杂化,正四面体型为()杂化。”相关问题
-
第1题:
根据杂化轨道理论,苯环中碳原子的结构特点是下列哪一种
A、未杂化的P轨道
B、sp2杂化
C、sp杂化
D、sp杂化和未杂化的P轨道
E、sp2杂化和未杂化的P轨道
参考答案:E
-
第2题:
在OF2分子中,氧原子成键的杂化轨道是下列中哪种杂化轨道?A. sp3杂化
B. sp杂化
C.sp2杂化
D.sp3不等性杂化答案:D解析:提示:考查如何判断中心原子的杂化类型。 -
第3题:
什么是杂化和杂化轨道?杂化轨道的数目与什么有关?
正确答案:同一原子中能量相近的某些原子轨道,在成键过程中重新组合成一系列能量相等的新轨道而改变了原有轨道的状态.这一过程称为杂化.所形成的新轨道叫做杂化轨道。杂化轨道的数目等于参与杂化的原子轨道的总数 -
第4题:
配离子〔Ni(CN)4〕2-的磁矩等于0.0B.M,判断其空间构型和中心原子的杂化轨道为()
- A、四面体和sp3杂化
- B、平面正方形和dsp2杂化
- C、八面体和sp3d2杂化
- D、八面体和d2sp3杂化
正确答案:B -
第5题:
据杂化轨道理论,H2S分子的杂化方式是()。
- A、sp等性杂化
- B、sp2 不等性杂化
- C、sp3等性杂化
- D、sp3不等性杂化
正确答案:D -
第6题:
关于杂化轨道理论,下列说法错误的是()。
- A、杂化轨道是由不同原子的外层能量相近的原子轨道组合而成
- B、有几个原子轨道参加杂化,就形成几个杂化轨道
- C、杂化轨道比杂化前的原子轨道成键能力强
- D、不同类型的杂化轨道间的夹角不同
正确答案:A -
第7题:
关于杂化轨道的类型,下列说法不正确的是()。
- A、sp杂化轨道
- B、sp2杂化轨道
- C、sp3杂化轨道
- D、孤电子杂化轨道
正确答案:D -
第8题:
什么叫轨道杂化?什么就杂化轨道?什么是杂化能?
正确答案:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。处于杂化轨道上电子的能量称为杂化能。 -
第9题:
杂化轨道理论指出乙烯碳为()杂化。
- A、sp杂化
- B、sp2杂化
- C、sp3杂化
正确答案:B -
第10题:
在OF2分子中,氧原子成键的杂化轨道是下列中哪种杂化轨道?()
- A、sp3杂化
- B、sp杂化
- C、sp2杂化
- D、sp3不等性杂化
正确答案:D -
第11题:
根据杂化轨道理论,苯的碳原子为()杂化。
- A、sp杂化
- B、sp2杂化
- C、sp3杂化
正确答案:B -
第12题:
单选题用杂化轨道理论推测下列分子的空间构型,其中为正四面体的是( )。ASiH4
BCH3Cl
CCHCl3
DBBr3
正确答案: B解析:
杂化轨道数目取决于参加杂化的轨道数,即一个原子中能量相近的n个原子轨道,可以而且只能形成n个杂化轨道,SiH4中Si采取等性的sp3杂化,形成正四面体结构;BC两项中的中心原子采取不等性sp3杂化,为四面体结构;D项中B采取sp2杂化,形成平面三角形结构。 -
第13题:
用杂化轨道理论推测下列分子的空间构型,其中为正四面体的是( )。A.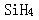
B.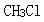
C.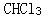
D.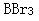 答案:A解析:杂化轨道数目取决于参加杂化的轨道数,即一个原子中能量相近的n个原子轨道,可以而且只能形成n个杂化轨道,SiH4中Si采取等性的sp3杂化,形成正四面体结构;BC两项中的中心原子采取不等性sp3杂化,为四面体结构;D项中B采取sp2杂化,形成平面三角形结构。
答案:A解析:杂化轨道数目取决于参加杂化的轨道数,即一个原子中能量相近的n个原子轨道,可以而且只能形成n个杂化轨道,SiH4中Si采取等性的sp3杂化,形成正四面体结构;BC两项中的中心原子采取不等性sp3杂化,为四面体结构;D项中B采取sp2杂化,形成平面三角形结构。 -
第14题:
下列各种说法中正确的是?
A.凡是中心原子采用sp3杂化轨道成键后形成的分子,其空间构型都是正四面体
B.凡AB3型的共价化合物,其中心原子均采用sp2杂化轨道成键
C.在AB2型的共价化合物中,中心原子均采用sp杂化轨道成键
D. sp3杂化可分等性sp3杂化和不等性sp3杂化答案:D解析:提示:通过sp杂化后形成的分子为直线;通过sp2杂化后形成的分子为正三角形,也有V字形的;通过SP3杂化后形成的分子有正四面体、三角锥形,还有V字形。 -
第15题:
已知配离子〔CuCl4〕2-的磁矩等于零,其空间构型和中心离子使用的杂化轨道分别是()
- A、四面体型和sp3杂化
- B、平面正方形和dsp2杂化
- C、八面体型和d2sp3杂化
- D、八面体型和sp3d2杂化
正确答案:A -
第16题:
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为()。
- A、直线形,sp杂化
- B、三角形,sp2杂化
- C、三角锥形,sp2杂化
- D、三角锥形,sp3杂化
正确答案:D -
第17题:
根据杂化轨道理论,H2O分子的杂化方式是()。
- A、sp等性杂化
- B、sp2不等性杂
- C、sp3等性杂化
- D、sp3不等性杂化
正确答案:D -
第18题:
已知Cu为29号元素,试推测Cu(Ⅱ)在与氨形成配合物时其配位数,杂化类型和空间构型为()
- A、4,sp3杂化,正四面体
- B、4,dsp2杂化,平面正方形
- C、6,sp3d2杂化,八面体型
- D、4,sp2d杂化,平面正方形
正确答案:B -
第19题:
sp3杂化轨道的空间结构为四面体形。
正确答案:正确 -
第20题:
按照杂化轨道理论,在CH4分子中,C原子采用sp3杂化轨道与H原子的1s轨道成键,形成一个空间构型为正四面体的分子。H2O分子中O原子用不等性sp3杂化轨道成键,分子的几何构型是()。
正确答案:V字型 -
第21题:
杂化轨道认为,H2O分子中的氧原子提供的成键轨道是()。
- A、等性SP2杂化轨道
- B、不等性SP2杂化轨道
- C、等性SP3杂化轨道
- D、不等性SP3杂化轨道
正确答案:D -
第22题:
碳的一个s轨道和3个轨道杂环,生成能量相同的4个()杂环轨道。
- A、sp杂化
- B、sp2杂化
- C、sp3杂化
正确答案:C -
第23题:
单选题H2S分子中,S原子成键的杂化轨道类型为( )。Asp3杂化
Bsp杂化
Csp2杂化
Dsp3不等性杂化
正确答案: C解析:
S原子(价电子构型为3s23p4)在成键过程中,有1个3s轨道和3个3p轨道组合成sp3不等性杂化轨道。因为其中2个sp3杂化轨道已为孤对电子所占据,其余2个不等性sp3杂化轨道和2个H原子的1s轨道重叠,形成2个S—H σ键。 -
第24题:
单选题关于杂化轨道的类型,下列说法不正确的是()。Asp杂化轨道
Bsp2杂化轨道
Csp3杂化轨道
D孤电子杂化轨道
正确答案: D解析: 暂无解析
