某盐水溶液,无色,加入硝酸银溶液后,产生白色沉淀;加入氢氧化钙并加热,刺激性气味气体放出。盐可能是()A、氯化钠B、氯化铵C、醋酸锌D、硝酸汞
题目
某盐水溶液,无色,加入硝酸银溶液后,产生白色沉淀;加入氢氧化钙并加热,刺激性气味气体放出。盐可能是()
- A、氯化钠
- B、氯化铵
- C、醋酸锌
- D、硝酸汞
相似考题
更多“某盐水溶液,无色,加入硝酸银溶液后,产生白色沉淀;加入氢氧化钙并加热,刺激性气味气体放出。盐可能是()A、氯化钠B、氯化铵C、醋酸锌D、硝酸汞”相关问题
-
第1题:
现有A、B、C三种盐,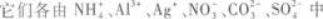 的两种离子组成.它们都易溶于水,用其水溶液做如下实验,实验现象是:
的两种离子组成.它们都易溶于水,用其水溶液做如下实验,实验现象是:
(1)向3种溶液中分别加入盐酸并加热,A溶液与盐酸不反应;B溶液有白色沉淀生成;C
溶液则生成无色无味气体.
(2)向A溶液中加入氢氧化钠溶液,先生成白色沉淀,再继续加氢氧化钠溶液时,沉淀消失.
(3)向C溶液中加入过量氢氧化钠溶液并加热,产生一种有刺激性气味的气体.根据以上现象,可判断A为____________,C为____________答案:解析: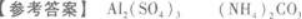 【解题指要】
【解题指要】
(1)向三种溶液中分别加入盐酸并加热.
①B溶液产生白色沉淀,说明B溶液中含有Ag+.易溶于水的银盐只有AgNO3,所以B物质
是AgNO3.

(2)向A溶液中加入NaOH溶液.

所以,A物质是Al2(SO4)3,B物质是AgNO3,C物质是(NH4)2CO3. -
第2题:
向某溶液中加入过量盐酸生成白色沉淀,过滤后向滤液中加入过量的氨水(使溶液呈碱性).又有白色沉淀生成:再过滤后向滤液中加入碳酸钠溶液,又生成白色沉淀。则原溶液中含有的离子可能是()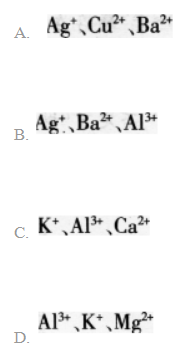 答案:B解析:
答案:B解析:
-
第3题:
某酸性溶液(可能含有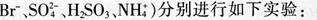
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝
③加入氯水时,溶液略显黄色,再加人BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是( )。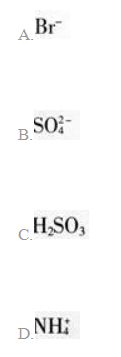 答案:B解析:
答案:B解析:
-
第4题:
检验某溶液是否含有S2O32-的方法为()
- A、加稀盐酸溶液变浑浊
- B、加稀盐酸溶液变浑浊且有刺激性气味的气体生成
- C、该溶液能使AgBr沉淀溶解
- D、加入AgNO3至生成白色沉淀,沉淀颜色由白变黄变棕最后变黑
- E、能吸收少量氯气
正确答案:B,D -
第5题:
含有ⅠA和ⅠB两种离子的混合液,向其中加入氯化钠溶液产生白色沉淀A,过滤分离后,向A中加入氨水部分溶解为无色溶液B,往其中加硝酸产生白色沉淀C,而部分沉淀A加氨水后转化为灰黑色沉淀D.将D溶于硝酸形成无色溶液,往此溶液中加入KI产生桔红色沉淀E.A,B,C,D,E各为何物。
正确答案:A.AgCl和Hg2cl2
B.Ag(NH3)2+
C.AgCl
D.HgNH2Cl和Hg
E.HgI2 -
第6题:
14mg某黑色固体A,与浓NaOH共热时产生无色气体B 22.4ml(标况下)。A燃烧的产物为白色固体C,C与氢氟酸反应时,能产生一无色气体D,D通入水中时产生白色沉淀E及溶液F,E用适量的NaOH溶液处理可得溶液G,G中加入氯化铵溶液则E重新沉淀,溶液F加过量的NaCl时得一无色晶体H。试判断各字母所代表的物质。
正确答案: A─Si
B─H2
C─SiO2
D─SiF4
E─H2SiO3
F ─H2SiF6
G─Na2SiO3
H─Na2SiF6 -
第7题:
在氯化汞溶液中,通入气体A,产生白色沉淀B,将B过滤,在所得滤液中加入氯化钡溶液产生白色沉淀C,其不溶于硝酸,将白色沉淀B转入氯化钠溶液产生黑色沉淀D.将D在空气中加热转化为红色固体物质E.判断A,B,C,D,E各为何物。
正确答案:A.SO2
B.Hg2Cl2
C.BaSO4
D.Hg
E.HgO -
第8题:
检验烧碱中含纯碱的最佳方法是()
- A、加热有气体生成;
- B、焰色反应为黄色火焰;
- C、加入CaCL2溶液有白色沉淀生成;
- D、加入BaCl2溶液有白色沉淀生成。
正确答案:C -
第9题:
某盐水溶液,无色,加入硝酸银溶液后,产生白色沉淀;加入氢氧化钙并加热,刺激性气味气体放出。盐可能是()。
- A、氯化钠
- B、氯化铵
- C、醋酸锌
- D、硝酸汞
正确答案:B -
第10题:
在盛有无色溶液A的试管中,加数滴NaCl溶液,产生白色沉淀,再加入几滴氨水,摇动后沉淀消失,再加入几滴KBr溶液后,又有谈黄色沉淀产生,再加入Na2S2O3溶液后,沉淀又消失,推断A为(),其有关离子反应式(),(),(),()。
正确答案:AgNO3;Ag++Cl-=AgCl;AgCl+2NH3=[Ag(NH3)2]++Cl-;[Ag(NH3)2]++Br-=AgBr2+NH3;AgBr+2S2O32-=[Ag(S2O3)2]3-+Br- -
第11题:
有一种白色固体A,加入油状无色液体B,可得紫黑色固体C。C微溶于水,加入A后溶解度增大,成棕色溶液D。将D分成两份,一份中加入一种无色溶液E,另一份通入气体F,都变成无色透明溶液。E溶液遇盐酸变为乳白色浑浊液。将气体F通入溶液E,在所得的溶液中加入BaCl2溶液,有白色沉淀,该沉淀物不溶于HNO3。试确定A,B,C,D,E,F各是什么物质?
正确答案:A.KI
B.浓H2SO4
C.I2
D.KI3
E.Na2S2O3
F.Cl2 -
第12题:
问答题有一块合金,由三种成分组成,其中一种可用来制照明弹.将此合金进行如下处理: (1)将合金放入热的氢氧化钠溶液中,合金部分溶解并产生气体.过滤,得到溶液A,不溶物B; (2)向A中加入适量盐酸,有白色沉淀生成,继续加入盐酸,白色沉淀减少但不完全消失,过滤得到溶液C,不溶物D; (3)向C中加入过量氨水,有白色沉淀E生成,E不溶于氨水,但能溶于烧碱溶液; (4)B可溶于盐酸,生成溶液F,并放出无色气体,向F中加入氨水,生成白色沉淀G,G不溶于氨水,也不溶于烧碱溶液. 根椐以上事实,判断此合金的三种成分是什么?A、B、C、D、E、F、G各是什么物质?正确答案: 合金三种成分中,一种可用来制照明弹,大概推知含镁.合金放入热的氢氧化钠溶液中,合金部分溶解并产生气体,则可推知可能含Al、Si,这两者在浓NaOH溶液中都能放出H2.再综合(1)、(2)、(3)、(4)各种现象,结合中学所学金属的知识知此合的成分为镁、铝、硅,A为NaAlO2和Na2SiO3的混合溶液,B为金属镁,依次可推知C为AlCl3,D为H2SiO3,E为Al(OH)3,F为MgCl2,G为Mg(OH)2.
因此此合金的成分为镁、铝、硅;A、B、C、D、E、F、G分别为NaAlO2和Na2SiO3的混合溶液、Mg、AlCl3、Al(OH)3、H2SiO3、MgCl2、Mg(OH)2.解析: 暂无解析 -
第13题:
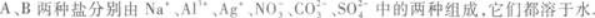
(1)往两种溶液中分别加入盐酸,A溶液不反应,B溶液产生无色无味气体.
(2)往两种溶液中分别加入过量NaOH溶液,A溶液先产生白色沉淀,然后沉淀消失,B溶液与NaOH不反应.
(3)往两种盐溶液中分别加入BaCl2溶液,都产生白色沉淀.再分别加入稀HNO3,A中沉淀不消失,B中沉淀消失.由此可知,A的化学式为____________,B的化学式为____________.答案:解析:Al2(SO4)3 Na2CO3 【解题指要】 解答此类题目,应熟知各种离子的鉴别反应及反应的特殊现象.另外,分析时应全面照顾,不要漏掉条件.
(1)加入盐酸,B溶液产生无色无味气体.在给出的6种离子中只

即B一定是碳酸盐.
(2)加入过量NaOH溶液,A溶液先产生白色沉淀,然后沉淀消失,显然这是Al3+的特征反应.其反应方程式为
即A中一定含有Al3+,是铝盐.
(3)向A、B溶液中分别加入BaCl2溶液,都有白色沉淀生成.再分别加入稀HNO3,A中沉淀

-
第14题:
下列说法错误的是A.硫酸铵化肥加入熟石灰研磨能嗅到刺激性气味
B.含Cl-的盐溶液能与AgNO3溶液反应,产生白色沉淀
C.含SO42-的盐溶液能与Ba(NO3)2溶液反应,产生白色沉淀
D.某盐能与盐酸反应放出使澄清石灰水变浑浊的气体,该盐一定是含有CO32-的盐答案:D解析: -
第15题:
铁铵钒指示剂法测定挂面中氯化钠的含量,样品在经处理、酸化后,加入硝酸银溶液,使之与硝酸银生成()氯化银沉淀。
- A、白色
- B、无色
- C、淡红色
- D、淡蓝色
正确答案:A -
第16题:
有一瓶两种阴离子混合的溶液,加入HCl有浑浊现象,且有刺激性气味产生,加入过量的HCl,再加入BaCl2溶液有白色沉淀产生,问阴离子溶液的组成,并写出反应方程式
正确答案:SO42-,S2O32-
S2O32-+2H+=S↓+SO2↑+H2O
Ba2++SO42-=BaSO4↓ -
第17题:
有一种可溶性的白色晶体A(钠盐),加入无色油状液体B的浓溶液,可得一种紫黑色固体C,C在水中溶解度较小,但可溶于A的溶液成棕黄色溶液D,将D分成两份,一份中加入一种无色(钠盐)溶液E,另一份中通入过量气体F,都变成无色透明溶液,E溶液中加入盐酸时,出现乳白色混浊,并有刺激性气体逸出,E溶液中通入过量气体F后再加入BaCl2溶液有白色沉淀产生,该沉淀不溶于HNO3.问:1).A,B,C,D,E,F,各是何物2).写出下列反应方程式A+B-→CE+HCl- D+F-→E+F→
正确答案:1).A:NaI;B:H2SO4(浓);C://I2;D://NaI3; E://Na2S2O3;F://Cl2
2).8NaI+5H2SO4(浓)=4I2+H2;+4Na2SO4+4H2O
I3-+8Cl2+9H2O=3IO3-+16Cl-+18H
Na2S2O3+2HCl=2NaCl+SO2↑+S↓+H2O
Na2S2O3+4Cl2+5H2O=2H2SO4+2NaCl+6HCl -
第18题:
钛与浓热盐酸反应的现象是()
- A、放出气体得到无色溶液
- B、放出气体,并生成白色沉淀
- C、生成白色沉淀和紫色溶液
- D、生成紫色溶液并放出气体
正确答案:D -
第19题:
红色固体氧化物Ⅰ,与稀HNO3作用时部分溶解而生成无色溶液Ⅱ及棕色沉淀Ⅲ.将Ⅲ分离出来,Ⅲ能与浓盐酸反应产生有刺激性气味的黄绿色气体.将此气体通入KI溶液中,使溶液呈黄棕色.若在溶液Ⅱ中加入KI溶液则得一亮黄丝状沉淀Ⅳ.Ⅳ加热时会溶解,冷却时析出,加入KI溶液沉淀又复溶解,以上现象说明:Ⅰ是?,Ⅱ是?,Ⅲ是?,Ⅳ是?A.PbO、B.PbO2、C.Pb3O4、D.PbI2、E.Pb(NO3)2
正确答案:Ⅰ(C)Ⅱ(E)Ⅲ(B)Ⅳ(D) -
第20题:
某盐水溶液,无色,加入硝酸银溶液后,产生白色沉淀,加入氢氧化钙并加热,有刺激性气味气体放出。该盐可能是()。
- A、氯化钠;
- B、氯化铵;
- C、醋酸锌;
- D、硝酸汞
正确答案:B -
第21题:
在无色溶液A中加入NaOH产生褐色沉淀B,若加入NaH2PO4产生黄色沉淀C.将B过滤,部分滤液放入试管中加入适量浓H2SO4,再加入适量FeSo4溶液产生棕色环D,将B溶于HNO3,再滴加NaCl溶液过程中先产生白色沉淀E,而后E沉淀消失变成无色溶液F,将E放入Na2S2O3溶液中则E溶解为无色溶液G.判断A,B,C,D,E,F,G各为何物
正确答案:A.AgNO3
B.Ag2O
C.Ag3PO4
D.Fe(NO)2+
E.AgCl
F.AgCl2-
G.[Ag(S2O3)2]3- -
第22题:
在铝酸盐溶液中加入足量的氢氧化钠固体则()
- A、生成白色沉淀
- B、有气体放出
- C、先生成白色沉淀,而后沉淀消失
- D、生成白色沉淀,并放出气体
正确答案:D -
第23题:
单选题以下实验能确定某溶液中一定含有SO42-的是( ).A加入硝酸酸化,再加入BaCl2溶液,产生白色沉淀
B加入硫酸酸化,再加入BaCl2溶液,产生白色沉淀
C加入用盐酸酸化的Ba(NO3)2溶液,产生白色沉淀
D加入Ba(NO3)2溶液,产生白色沉淀,再加入盐酸或硝酸,无反应现象
正确答案: B解析:
A项,硝酸有强氧化性,能把SO32-氧化成SO42-,而产生BaSO4沉淀;B项若用硫酸酸化,则引入了SO42-;C项,用盐酸酸化时,若溶液中不含SO42-,但含Ag+也会产生白色沉淀;D项,只有先加入Ba(NO3)2溶液产生白色沉淀,再加盐酸或稀硝酸沉淀不溶解,才能证明溶液中一定含有SO42-. -
第24题:
填空题有一瓶溶液,可能含有Na+、K+、NH4+、Cl-、SO42-、CO32-中的一种或几种,实验步骤及现象如下: (1)取少许溶液进行焰色反应,火焰呈黄色,透过蓝色钴玻璃,观察不到浅紫色. (2)取少许溶液加入NaOH溶液并加热,不产生刺激性气体. (3)取少许溶液盛于试管中,加入Ba(NO3)2溶液,生成白色沉淀,再加入稀HNO3,白色沉淀全部溶解,继续加入HNO3至溶液呈酸性,并加热,然后加入AgNO3溶液,有白色沉淀生成. 根据以上实验,可以判断,这瓶溶液中肯定含有____;肯定不含有____.正确答案: Na+、Cl-、CO32-,NH4+、K+、SO42-解析:
(1)从焰色反应实验可断定这瓶溶液中肯定含有Na+,不含有K+;
(2)从加入少许NaOH溶液加热不产生刺激性气体,可断定这瓶溶液中不含有NH4+;
(3)加入Ba(OH)2溶液产生白色沉淀,沉淀可能是BaSO4,也可能是BaCO3,再加入稀硝酸,沉淀全部溶解,则可以断定溶液中不含有SO42-(因BaSO4不溶于稀硝酸),含有CO32-,加入稀HNO3后再加入AgNO3,生成不溶于稀HNO3的AgCl,可以断定溶液中含有Cl-.
