元素X、Y、Z均为短周期元素,且原子序数依次增大.在一定条件下,X能跟Y化合,生成无色无味的气态物质XY2.0.1 mol Z的单质跟足量盐酸反应,生成2.24 L(标准状况下)氢气.则XY2的化学式为____________,Y的原子结构示意图为____________,Z的元素符号是____________.
题目
相似考题
参考答案和解析
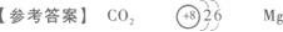 【解题指要】 (1)X、Y为短周期元素,能相互化合生成无色无味的气态物质XY2.首先考
【解题指要】 (1)X、Y为短周期元素,能相互化合生成无色无味的气态物质XY2.首先考
虑符合XY2形式的气体只有CO2、SO2和NO2.其中,NO2有色又有味,SO2无色但有刺激性气味,只有CO2无色无味.所以X为C元素,Y为O元素.
(2)Z的单质与盐酸反应,可生成氢气.所以Z必是金属元素.用M表示该金属,并设其化
合价为x,可写出Z与盐酸反应的化学方程式:
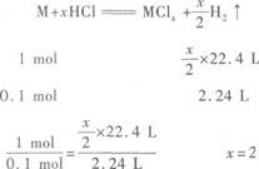
该金属为C、O元素之后的短周期元素,所以只能是Mg.
更多“元素X、Y、Z均为短周期元素,且原子序数依次增大.在一定条件下,X能跟Y化合,生成无色无味的气态物质XY2.0.1 mol Z的单质跟足量盐酸反应,生成2.24 L(标准状况下)氢气.则XY2的化学式为____________,Y的原子结构示意图为____________,Z的元素符号是____________.”相关问题
-
第1题:
同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是:
A.单质的化学活泼性:W<X<Y<Z B.原子最外层电子数:W<X<Y<Z
C.单质的氧化能力:W<X<Y<Z D.元素的最高化合价:W<X<Y<Z
正确答案:B
-
第2题:
⑵X和Y反应生成Z和W,其中Y、W常作灭火剂,X、Z均含3种元素,W的化学式为________,X的化学式为________。
正确答案: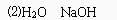
-
第3题:
下面关于函数依赖的叙述中,不正确的是
A.若X→Y,Y→Z,则X→Z
B.若X→Y,且Y′ Y,则X→Y′
C.若X→Y,X→Z,则X→YZ
D.若XY→Z,则X→Z,Y→Z
正确答案:D
解析:选项A为传递律,选项B为分解规则,选项C为合并规则,而合并规则不是可逆的,所以选项D不正确,即为本题的答案。 -
第4题:
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
正确答案:D
-
第5题:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )。
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的简单气态氢化物的热稳定性比W强答案:D解析:由X、Y、Z、W的原子序数依次增大,x原子的最外层电子数是其内层电子数的2倍,可知X是C元素;Y是地壳中含量最高的元素,因此Y是0元素;Z2+和Y2-一具有相同的电子层结构,因此Z是Mg元素;W和X位于同主族,因此W是Si元素。A项,原子半径顺序应该是r(Z)>r(W)>r(X)>r(Y),A项错误;B项,Y与Z形成的化合物是M90,化学键是离子键,Y与W形成的化合物是Si02,化学键是共价键,B项错误;C项,同主族元素从上到下最高价氧化物对应的氧化物的酸性依次减弱.C项错误:D项,同周期元素对应的气态氢化物的稳定性从左到右依次增强,同主族的元素气态氢化物的稳定性从上到下依次减弱.故Y的简单气态氢化物的热稳定性比W的强.故D正确。 -
第6题:
X、Y、z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )。 答案:A解析:X、Y、Z均为短周期元素,Y+、Z-具有相同的电子层结构,说明Y位于2的下一周期,同时X、Y处于同一周期,X、Z的最低价离子分别为X2-、Z-,说明X是
答案:A解析:X、Y、Z均为短周期元素,Y+、Z-具有相同的电子层结构,说明Y位于2的下一周期,同时X、Y处于同一周期,X、Z的最低价离子分别为X2-、Z-,说明X是
-
第7题:
短周期主族的非金属元素X、Y、Z在周期表中的位置如图所示,下列有关说法一定正确的是( )。 A、气态氢化物的稳定性:Z>Y>X
A、气态氢化物的稳定性:Z>Y>X
B、第一电离能:Z>Y>X
C、含氧酸的酸性:Z>Y>X
D、元素的最高化合价:Z=Y>X答案:A解析:同周期元素,从左到右,非金属性逐渐增强;同主族元素,从上到下,非金属性逐渐减弱。非金属性越强,气态氢化物越稳定,A项正确。若X是P,Y是S,Z是O,则第一电离能Z>X>Y,B项错误。若X是S,Y是Cl,Z是F,F没有含氧酸,F没有正化合价,C、D项错误。故本题选A。 -
第8题:
某醛W能被氧化成为饱和一元羧酸X。在一定条件下,W又能与等物质的量的氢气加成生成饱和一元醇Y。X和Y能反应生成有机物Z。下列叙述正确的是()
- A、W、Z两物质具有相同的最简式
- B、Z的相对分子质量是W的相对分子质量的2倍
- C、等质量的W、Z完全燃烧消耗氧气的量不等
- D、等质量的W、Z完全气化后在相同状况下的密度不同
正确答案:A,B,D -
第9题:
设X、Y、Z代表三种元素。已知: (1)X+和Y-两种离子具有相同的电子层结构; (2)Z元素原子核内质子数比Y元素原子核内质子数少9个; (3)Y和Z两种元素可以形成4核42电子的价阴离子。 据此,请填空: (1)Y元素是(),Z元素是()。 (2)由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是()。
正确答案:氯;氧;KClO4 -
第10题:
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题: (1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:()、()、()、()等。 (2)若X原子的外围电子层排布为3d104s2,Y可能是()元素或()元素(写元素符号)。 (3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:()、()、()、()、()、()、()。
正确答案:CO2;SO2;SiO2;CS2;F;Cl;1s2;2s2;3s2;4s2;3d64s2;3d94s2;3d104s2 -
第11题:
填空题X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件: ①元素周期表中,Z与Y相邻,Z与W也相邻; ②Y、Z和W三种元素的原子最外层电子数之和为17。 请填空: (1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):(),理由是()。 (2)Y是(),Z是(),W是()。 (3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式()。正确答案: 否,若同一周期左右相邻,则X-1+X+X+1=17,X为小数,O,N,S,名称为:硫酸铵,化学式为:(NH4)2SO4解析: 本题是一个相对比较简单,但又比较综合的元素周期律问题。主要涉及周期表中的元素位置关系,元素形成物质化学式确定,元素确定等问题。所要求的元素并没有超过短周期的要求。
根据条件(2),Y,Z,W最外层电子数之和为17,又Y与Z,Z与M均有相邻关系,短周期又必须是主族元素,故Z,Y,W的最外层电子数必可设为X,X,X+1或X,X,X-1有X+X+X+1=17或X+X+X-1=17,计算结果为:X=6,各元素最外层电子数为6,6,5且Z必为6。Y,Z,W原子序数依次增大,则电子层排布只能是Y:2,5,为N元素;Z:2,6,为O元素;W:2,8,6,为S元素。在根据X,Y,Z,W组成的化合物中各原子个数比为8:2:4:1,X必为化合价为1的H,形成的化合物为(NH4)2SO4。 -
第12题:
问答题已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:若X、Y均为非金属元素,写出你所知道的XY2的化学式。正确答案: CO2、SO2、SiO2、CS2解析: 暂无解析 -
第13题:
下列( )是伪传递规则。
A.若X→Y, 且X→Z, 则X→YZ
B.若X→Y, 且AY→Z, 则XA→Z
C.若X→Y, 且Z→Y, 则X→Y
D.若X→Y, 且Y→Z, 则X→Z
正确答案:B
解析:Armstrong公理系统的伪传递规则是:由X→Y,WY→Z,有XW→Z。对比可以知道选项B)是正确答案。 -
第14题:
( 53 )设 U 为所有属性, X 、 Y 、 Z 为属性集, Z = U - X - Y 。 下面关于平凡的多值依赖的叙述中,哪一条是正确的?
A )若 X →→ Y , 且 Z = Ф ,则称 X →→ Y 为平凡的多值依赖
B )若 X →→ Y , 且 Z ≠Ф ,则称 X →→ Y 为平凡的多值依赖
C )若 X → Y , 且 X →→ Y , 则称 X →→ Y 为平凡的多值依赖
D )若 X →→ Y , 且 X →→ Z , 则称 X →→ Y 为平凡的多值依赖
正确答案:A
-
第15题:
下面关于函数依赖的叙述中,正确的是( )。
Ⅰ、若X→Y,X→Z, 则X→YZ
Ⅱ、若XY→Z, 则X→Z,Y→Z
Ⅲ、若X→Y,Y→l 则X→Z
Ⅳ、若X→Y,Y→Y',则X→Y'
A.Ⅰ、 Ⅱ、Ⅲ
B.Ⅰ、Ⅳ
C.Ⅲ、Ⅳ
D.全部
正确答案:B
解析:根据函数依赖的几个概念和Armstrong公理系统的推理规则来逐个判断。Armstrong公理系统包括3条推理规则。①自反律。若YXU,则X→Y为F所逻辑蕴含。②增广律.若X→Y为F所逻辑蕴含,且ZU,则XZ→YZ为F所逻辑蕴含。③传递律。若X→Y及Y→Z为F所逻辑蕴含,则X→Z为F所逻辑蕴含。根据以上3条推理规则可以得到以下3条有用的规则。④合并规则。由X→Y,X→Z,有X→YZ。⑤伪传递规则。由X→Y,WY→Z,有XW→Z。⑥分解规则。由X→Y及ZY,有X→Z由规则④和规则⑥可以知道,Ⅰ和Ⅳ是正确的。Ⅱ显然是错误的,因为在函数依赖关系中,决定因素的某个真子集不一定能确定一个函数依赖关系。再参照规则⑤,可以知道Ⅲ也是错误的。 -
第16题:
元素X、Y、Z都位于短周期,它们的原子序数按X、Y、Z的顺序依次增大。X和Z位于同一主族,Y和Z位于同一周期。Y的单质与2的单质相互作用,生成离子化合物Y2Z。则X原子的结构示意图为__________。Y2Z的电子式为__________。答案:解析: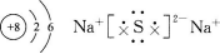
-
第17题:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和2-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )。.A.原子的最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X>Y>z-
D.原子序数:X>Y>Z答案:D解析:由于x、Y、z均为短周期元素,Y+与z一的电子层结构相同,所以两种元素位于相邻周期,则Y是Na,Z是F,则X是S。原子最外层电子数F>S>Na,A项错误;单质沸点:Na>S>F:,B项错误;离子半径:S2->F>Na十,C项错误;原子序数:S>Na>F,D项正确。故选D。 -
第18题:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )。A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强答案:D解析:【知识点】元素周期表
【解析】由题意可知,X为碳,Y为氧,Z为镁,W为硅,则原子半径镁大于硅,A项错误;氧化镁为离子键,二氧化硅为共价键,B项错误;碳酸的酸性大于硅酸,C项错误;水的热稳定性大于硅烷.D项正确。故本题选D。 -
第19题:
X、Y、Z、W、T为短周期元素,它们在周期表中的位置如图1所示。这五种元素的原子最外层电子数之和为26。下列说法正确的是( )。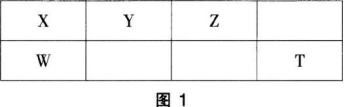 A.Y、Z、T三种元素最低价氢化物的沸点依次升高
A.Y、Z、T三种元素最低价氢化物的沸点依次升高
B.T与X元素可形成化合物XT4
C.物质WZ2、WT4均有熔点高、硬度大的特性
D.由Y、Z和氢三种元素形成的化合物中只有共价键答案:B解析:五种元素的原子最外层电子数之和为26,根据其在周期表的位置,设X最外层电子数为x,则有:x+x+(x+1)+(x+2)+(x+3)=26,得出x=4,所以X、Y、Z、W、T分别为C、N、O、Si、Cl。常温下,N、O的氢化物为氨和水,Cl的氢化物为HCl,氨和水存在氢键,沸点高于HCl,A项错误。Cl与C可形成CCl4,B项正确。WZ2、WT4分别为SiO2、SiCl4,SiCl4为分子晶体,熔点低、硬度低,C项错误。N、O、H可形成硝酸铵,其为离子化合物,既存在共价键也存在离子键,D项错误。 -
第20题:
下列关于化学反应2X+Y=2Z的叙述,正确的是()。
- A、Z一定是化合物
- B、在反应中X、Y、Z三种物质的粒子数目比为2:1:2
- C、若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为(M+N)
- D、若agX完全反应生成bgZ,则同时消耗(b—a)gY
正确答案:A,B,D -
第21题:
短周期元素分别为X、Y和Z,已知X元素的原子最外层只有1个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L层上的电子数比Y元素原子的L电子层上的电子数少2个,则三种元素所形成的化合物的分子式不可能是()
- A、X2YZ4
- B、XYZ3
- C、X3YZ4
- D、X4Y2Z7
正确答案:A -
第22题:
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:若X、Y均为非金属元素,写出你所知道的XY2的化学式。
正确答案:CO2、SO2、SiO2、CS2 -
第23题:
填空题已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题: (1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:()、()、()、()等。 (2)若X原子的外围电子层排布为3d104s2,Y可能是()元素或()元素(写元素符号)。 (3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:()、()、()、()、()、()、()。正确答案: CO2,SO2,SiO2,CS2,F,Cl,1s2,2s2,3s2,4s2,3d64s2,3d94s2,3d104s2解析: 暂无解析
