等体积等物质的量浓度的氢氧化钡溶液和盐酸溶液混合后,加入石蕊试液,溶液呈()色。A、蓝B、红C、紫D、无
题目
等体积等物质的量浓度的氢氧化钡溶液和盐酸溶液混合后,加入石蕊试液,溶液呈()色。
A、蓝
B、红
C、紫
D、无
相似考题
更多“等体积等物质的量浓度的氢氧化钡溶液和盐酸溶液混合后,加入石蕊试液,溶液呈()色。 ”相关问题
-
第1题:
等体积混合0.1 mol/L盐酸和0.06 mol/L氢氧化钡溶液,混合后溶液的pH=____________.答案:解析:12【解题指要】
(1)设酸和碱溶液的体积均为1 L,则盐酸溶液中含HCl为0.1 mol/L×1 L=0.1 mol;
Ba(OH)2溶液中含Ba(OH)2为0.06 mol/L×l L=0.06 mol.
(2)两溶液混合时,要发生化学反应
因此,混合后可能有以下三种情况:
①恰好完全反应.因BaCl2是强酸强碱盐,所以溶液显中性.
②酸有剩余,溶液显酸性.
③碱有剩余,溶液显碱性.
究竟属于哪一种情况,需经计算才能知道.
设与盐酸完全反应需Ba(OH)2xmol,则
所以Ba(OH)2剩余:0.06 mol-0.05 mol=0.01mol.
(3)计算混合后溶液的pH.

OH一的物质的量浓度为0.005 mol/L×2=0.01mol/L,则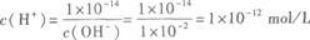
即pH=12. -
第2题:
常温下,在含有等浓度的HF和NaF的混合溶液中,加入少量盐酸或烧碱后,该溶液的pH值均基本上维持不变。
①常温下碱性溶液中PH>7,NaF溶液的pH大于7说明呈碱性,说明NaF发生了水解,HF是弱酸,故①正确; ②导电性强弱主要与离子浓度有关,不能说明HF是弱酸,故②错误; ③HF与NaCl不能发生反应与HF是弱酸无关,故③错误; ④常温下0.1mol/L的HF溶液的pH为2.3说明HF部分电离是弱酸,故④正确; ⑤HF能与Na 2 CO 3 溶液反应,产生CO 2 气体说明HF的酸性比碳酸的强,不能说明HF是弱酸,故⑤错误; ⑥HF与水能以任意比混溶与HF的酸性无关,故⑥错误; ⑦1mol/L的HF水溶液能使紫色石蕊试液变红说明HF水溶液显酸性,不能说明HF是弱酸,故⑦错误; 故选D. -
第3题:
有两位同学进行蔗糖水解实验时,所用盐酸溶液浓度为c1,蔗糖溶液浓度为c2,他们分别用等体积的盐酸与蔗糖溶液混合,不等体积的盐酸与蔗糖溶液混合,则他们所测得的反应终止时体系旋光度分别为α1和α2则()
A.α1=α2
B.α1>α2
C.α1<α2
D.α1≠α2
B -
第4题:
42、下列属缓冲溶液的是
A.H2CO3和NaHCO3的混合溶液
B.NaOH和NaCl的混合溶液
C.过量氨水与盐酸混合后的溶液
D.HAc与NaOH恰好中和后的溶液
E.等物质的量的HAc与NH4Cl混合溶液
CNaOH与HAc反应后全部生成NaAc。 -
第5题:
4、在制备用于密度梯度离心的蔗糖溶液浓度梯度时,正确的做法是:
A.先将50%蔗糖溶液和15%蔗糖溶液等体积混合,再加入到离心管中
B.先加入高浓度的蔗糖溶液,再加入低浓度的蔗糖溶液,最后振荡混匀
C.先加入低浓度的蔗糖溶液,再加入高浓度的蔗糖溶液,小心静置
D.应沿着离心管壁先缓慢加入50%蔗糖溶液,再缓慢加入15%蔗糖溶液,小心静置
应沿着离心管壁先缓慢加入50%蔗糖溶液,再缓慢加入15%蔗糖溶液,小心静置
