用NaAc·3H2O(相对分子量137g/mol)晶体,2.0moI/LHAc来配制pH为5.0的HAc-NaAc缓冲溶液1升,其正确的配制是A.将49克NaAc·3H2O放入少量水中溶解,再加入50ml 2.0mol/L HAc 溶液,用水稀释1升B.将98克NaAc·3H2O放入少量水中溶解,再加入50ml 2.0mol/L HAc溶液,用水稀释1升C.将25克NaAc·3H2O放入少量水中溶解,再加入100ml 2.0moI/L HAc溶液,用水稀释1升D.将49克NaAc·3H2O放入少量水中溶解
题目
用NaAc·3H2O(相对分子量137g/mol)晶体,2.0moI/LHAc来配制pH为5.0的HAc-NaAc缓冲溶液1升,其正确的配制是
A.将49克NaAc·3H2O放入少量水中溶解,再加入50ml 2.0mol/L HAc 溶液,用水稀释1升
B.将98克NaAc·3H2O放入少量水中溶解,再加入50ml 2.0mol/L HAc溶液,用水稀释1升
C.将25克NaAc·3H2O放入少量水中溶解,再加入100ml 2.0moI/L HAc溶液,用水稀释1升
D.将49克NaAc·3H2O放入少量水中溶解,再加入100ml 2.0mol/L HAc溶液,用水稀释1升
相似考题
更多“用NaAc·3H2O(相对分子量137g/mol)晶体,2.0moI/LHAc来配制pH为5.0的HAc-NaAc缓冲溶液1升,其正确的配制是”相关问题
-
第1题:
HAc-NaAc缓冲溶液pH值的计算公式为( )
A.

B.

C.

D.
 正确答案:B
正确答案:B
-
第2题:
常温下,往1.0L0.10mol/LHAc溶液中加入一些NaAc晶体并使之溶解,可能发生的变化是( )。A.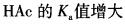
B.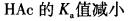
C.溶液的pH值增大
D.溶液的pH值减小答案:C解析: -
第3题:
用0.20mol·dm-3 HAc和0.20mol·dm-3 NaAc溶液直接混合(不加水),配制1.0 dm3 pH=5.00的缓冲溶液,需取0.20mol·dm-3 HAc溶液为() (pKa(HAc)=4.75)
- A、6.4×102cm3
- B、6.5×102cm3
- C、3.5×102cm3
- D、3.6×102cm3
正确答案:D -
第4题:
测定水的硬度时,用HAc-NaAc缓冲溶液来控制pH值
正确答案:错误 -
第5题:
HAc的Ka=1.76×10-5,欲配制pH=4.50的缓冲溶液,若用HAc及NaAc配制,则二者的浓度比cNaAc/cHAc为()。
- A、等于1
- B、大于1
- C、大于2
- D、小于1
正确答案:D -
第6题:
根据pH和PKa值越()缓冲容量越大的原则,配制pH=5.0的缓冲溶液,应选择()缓冲对,两者的摩尔比例为()。
正确答案:接近;CH3COONa-CH3COOH;1.74:1 -
第7题:
配制pH=6.00的缓冲溶液,可选择HAc和NaAc(pKa=4.75)。
正确答案:正确 -
第8题:
把NaAc晶体加到0.1mol/LHAc溶液中,将会有下列中哪种变化?()
- A、溶液pH值升高
- B、溶液pH值下降
- C、K增加
- D、K减小
正确答案:A -
第9题:
欲配制pH=4.50的缓冲溶液,若用HAc(pKa=4.75)和NaAc溶液,则缓冲比为()。
- A、9/8
- B、1/1.8
- C、1.8/1
- D、3/36
正确答案:B -
第10题:
单选题在HAc-NaAc的混合液中,HAc和NaAc的浓度都为0.1mol/L,HAc的Ka=1.8×10-5。此缓冲溶液的pH值为()。A4.74
B7.56
C8.86
D9.26
正确答案: C解析: 暂无解析 -
第11题:
判断题测定水的硬度时,用HAc-NaAc缓冲溶液来控制pH值A对
B错
正确答案: 错解析: 暂无解析 -
第12题:
判断题配制pH=6.00的缓冲溶液,可选择HAc和NaAc(pKa=4.75)。A对
B错
正确答案: 对解析: 暂无解析 -
第13题:
为配制 pH=5.05的缓冲溶液,已知 pKa(HAc)=4.75, 用等浓度的 HAc溶液和NaAc 溶液配制时,其体积比约为()A.2.0
B.0.5
C.0.3
D.1.0
参考答案:B
-
第14题:
在HAc-NaAc的混合液中,HAc和NaAc的浓度都为0.1mol/L,HAc的Ka=1.8×10-5。此缓冲溶液的pH值为()。
A4.74
B7.56
C8.86
D9.26
A
略 -
第15题:
用等体积C(HAc)=0.20摩尔/升和C(NaAc)=0.60摩尔/升溶液配制成的缓冲溶液,其pH值为多少?(pKHAc=4.74,KHAc=1.8310-5)
正确答案: 配制成的缓冲溶液pH值为5.22。 -
第16题:
配制pH=10的缓冲溶液,应选择的缓冲对是()
- A、HAc-NaAc(pKa=4.76)
- B、NaH2PO4-Na2HPO4(pKa=7.21)
- C、NH3-NH4Cl(pKa=9.24)
- D、Na2HPO4-Na3PO4(pKa=12.7)
正确答案:C -
第17题:
将MnS溶解在HAc-NaAc缓冲溶液中,系统的pH将()
- A、不变
- B、变小
- C、变大
正确答案:C -
第18题:
用NaAc•3H2O晶体,2.0mol/LNaOH来配制PH为5.0的HAc-NaAc缓冲溶液1升,其正确的配制是()
- A、将49克NaAc•3H2O放入少量水中溶解,再加入50ml2.0mol/LHAc溶液,用水稀释1升
- B、将98克NaAc•3H2O放入少量水中溶解,再加入50ml2.0mol/LHAc溶液,用水稀释1升
- C、将25克NaAc•3H2O放入少量水中溶解,再加入100ml2.0mol/LHAc溶液,用水稀释1升
- D、将49克NaAc•3H2O放入少量水中溶解,再加入100ml2.0mol/LHAc溶液,用水稀释1升
正确答案:C -
第19题:
现要配制pH=4.5的缓冲溶液,最理想的缓冲对是()。
- A、NaH2PO4-Na2HPO4(pK(H2PO4-)=7.21)
- B、HAc-NaAc(pK(HAc)=4.76)
- C、HCOOH-HCOONa(pK(HCOOH)=3.75)
- D、NH3-NH4Cl(pK(NH3)=4.75)
正确答案:B -
第20题:
已知Ka(HAc)为1.8×10-5,若用HAc和NaAc配制成pH=5的缓冲溶液,则HAc的浓度与NaAc的浓度之比正确的为()。
- A、8:9
- B、9:8
- C、5:9
- D、9:5
正确答案:C -
第21题:
已知Kaθ(HAc)=1.75×10-5,用0.025mol.L-1HAc溶液和等体积0.050mol.L-1NaAc溶液配制的缓冲溶液,其pH=(),在该溶液中加入很少量HCl溶液,其pH值将()。
正确答案:5.06;基本不变 -
第22题:
问答题用等体积C(HAc)=0.20摩尔/升和C(NaAc)=0.60摩尔/升溶液配制成的缓冲溶液,其pH值为多少?(pKHAc=4.74,KHAc=1.8310-5)正确答案: 配制成的缓冲溶液pH值为5.22。解析: 暂无解析 -
第23题:
填空题根据pH和PKa值越()缓冲容量越大的原则,配制pH=5.0的缓冲溶液,应选择()缓冲对,两者的摩尔比例为()。正确答案: 接近,CH3COONa-CH3COOH,1.74:1解析: 暂无解析 -
第24题:
单选题把NaAc晶体加到0.1mol/LHAc溶液中,将会有下列中哪种变化?()A溶液pH值升高
B溶液pH值下降
CKa增加
DKa减小
正确答案: C解析: Ka只与温度有关。HAc溶液中加入NaAc使HAc的电离平衡向左移动,CH+↓。
