已知某一元弱酸的浓度为c,用等体积的水稀释后,溶液的c(H+)浓度为()A.c/2B.C.D.
题目
已知某一元弱酸的浓度为c,用等体积的水稀释后,溶液的c(H+)浓度为()
A.c/2
B.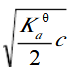
C.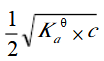
D.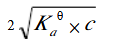
相似考题
更多“已知某一元弱酸的浓度为c,用等体积的水稀释后,溶液的c(H+)浓度为() ”相关问题
-
第1题:
常温下,0.1mol/L某一元弱酸,电离度为0.01%,下列说法正确的是()。
A.溶液pH值等于5
B.平衡时酸电离产生的[H+]约为水电离产生的[H+]的10000倍
C.若升高温度,溶液pH值增大
D.若用等体积等物质的量浓度的NaOH溶液与之反应,所得溶液的pH值大于7
设此一元弱酸为HX,则电离方程式为:HX=H + +X - ,设其电离度为α, 则电离的弱酸浓度为0.01α, 溶液pH=4,则电离出的[H + ]=10 -4 ,即0.01α=10 -4 ,故α=1%. 故选A. -
第2题:
A 为某一元酸的水溶液,B 为某一元碱的水溶液,两者的物质的量浓度相等,且 κ(A) < κ(B),若将两种溶液均稀释 1000 倍,此时有 κ(A) > κ(B),则
A.A 为强酸溶液,B 为强碱溶液
B.A 为强酸溶液,B 为弱碱溶液
C.A 为弱酸溶液,B 为强碱溶液
D.A 为弱酸溶液,B 为弱碱溶液
A 为弱酸溶液,B 为强碱溶液 -
第3题:
16、由于稀释效应使弱酸的离解度增大了,因而该弱酸溶液中H+的浓度必然增大。
错误 -
第4题:
已知298K时,浓度为0.010 mol·dm-3的某一元弱酸溶液的pH为4.00,则该酸的解离常数等于______;将该酸溶液稀释后,其pH将变______,解离度α将变_____,其KaΔ将______。
=;﹥;﹤ -
第5题:
下列说法是否正确?为什么? (1)将氨水和NaOH溶液的浓度各稀释为原来的1/2,则两种溶液中OH-浓度均减少为原来的1/2; (2)若HCl溶液的浓度为HAC溶液的2倍,则HCl溶液中H+浓度也为HAC溶液的2倍; (3)中和同溶液、等体积的一元酸所需的碱量基本上是相等的,所以同浓度的一元酸中H+浓度基本上也是相等的; (4)氨水的浓度越小,解离度越大,溶液中H+浓度也必然越大。
升高
