CaS晶体具有NaCl型结构,晶体密度为2.581g/cm3,Ca和S的相对原子质量分别为40.08和32.06。下列衍射中()是允许的。A.100B.110C.200D.210
题目
CaS晶体具有NaCl型结构,晶体密度为2.581g/cm3,Ca和S的相对原子质量分别为40.08和32.06。下列衍射中()是允许的。
A.100
B.110
C.200
D.210
相似考题
更多“CaS晶体具有NaCl型结构,晶体密度为2.581g/cm3,Ca和S的相对原子质量分别为40.08和32.06。下列衍射中()是允许的。”相关问题
-
第1题:
为使HAc溶液的电离度和溶液的pH都增加,往HAc溶液中加的物质应是下列中哪一种?A. NaAc 晶体
B. NaOH 晶体
C. HCl(g)
D. NaCl 晶体答案:B解析:提示:在HAc溶液中存在: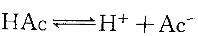 。为使电离度增加,必须使平衡向右移动;为使pH值增加,必须使H+离子浓度下降。
。为使电离度增加,必须使平衡向右移动;为使pH值增加,必须使H+离子浓度下降。 -
第2题:
同为碳元素组成的钻石与石墨的密度分别为()g/cm3,这与其各自晶体结构紧密程度有关。
- A、3.22与2.23
- B、3.52与2.23
- C、2.23与3.52
- D、3.52与3.22
正确答案:B -
第3题:
下列关于晶体性质的叙述,不合理的是( )。
- A、晶体具有各向异性的性质
- B、有些晶体材料整体具有各向同性的性质
- C、石英、金属属于晶体结构
- D、晶体的质点排列为近程有序,远程无序
正确答案:D -
第4题:
往醋酸溶液中加入少量下列哪种物质时,可使醋酸电离度和溶质的pH值都增大()?
- A、NaAc晶体
- B、NaOH晶体
- C、HCI(g)
- D、NaCl晶体
正确答案:B -
第5题:
晶体可按晶格空间结构的区别分为()
- A、不同的晶系
- B、原子晶体和离子晶体
- C、分子晶体和离子晶体
- D、金属晶体和非金属晶体
正确答案:A -
第6题:
矿物的相对密度取决于它的()。
- A、化学组成和物理性质
- B、化学组成和晶体结构
- C、晶体结构和晶体外形
- D、化学组成和物理相态
正确答案:B -
第7题:
晶体结构类型相同的情况下,组成矿物的离子半径增加幅度小于相对原子质量增加幅度时,矿物的相对密度主要取决于相对原子质量的大小。
正确答案:错误 -
第8题:
钾原子半径为235pm,金属钾晶体为体心立方结构。试确定每个晶胞内有()个原子,晶胞边长为()pm,晶胞体积为()cm3,并推算金属钾的密度为()g·cm-3。(钾的相对原子质量为39.1)
正确答案:2;543;1.60×10-22;0.812 -
第9题:
CO2,SiO2,MgO,Ca的晶体类型分别为(),(),(),()。
正确答案:分子晶体;原子晶体;离子晶体;金属晶体 -
第10题:
绝缘栅双极型晶体管具有电力场效应晶体管和电力晶体管的优点。
正确答案:正确 -
第11题:
问答题为什么在AX型晶体结构中,NaCl型结构最多?正确答案: 在AX型晶体结构中,一般阴离子X的半径较大,而阳离子A的半径较小,所以X做紧密堆积,A填充在其空隙中。大多数AX型化合物的r+/r-在0.414~0.732之间,应该填充在八面体空隙,即具有NaCl型结构;并且NaCl型晶体结构的对称性较高,所以AX型化合物大多具有NaCl型结构。解析: 暂无解析 -
第12题:
填空题岩盐(NaCl)晶体具有()晶格,每个晶胞包含()NaCl基元。正确答案: 面心立方(fcc),4个解析: 暂无解析 -
第13题:
往醋酸溶液中加入少量下列哪种物质时,可使酽酸电离度和溶质的pH值都增大?
A.NaAc 晶体 B.NaOH 晶体 C. HCl(g) D. NaCl 晶体答案:B解析:解:醋酸溶液中存在下列电离平衡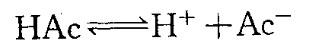
若加入NaAc或HCl,均会由于同离子效应使醋酸的电离度下降;当加入NaAc时,降低了H+浓度而使pH值升高;当加HCl时,增加了H+浓度而使pH下降。若加入NaCl,由于盐效应使醋酸电离平衡向右移动,使醋酸电离度增加,H+浓度升高、 pH值下降。
若加入NaOH,由于OH-与H+结合成H2O,降低了H+浓度,使PH值升高;同时使醋酸电离平衡向右移动而增加了醋酸的电离度。
所以答案为B。 -
第14题:
石灰硬化后生成的主要产物是()。
- A、Ca(OH)2晶体
- B、Ca(OH)2晶体与CaCO3晶体
- C、CaCO2晶体
正确答案:B -
第15题:
下列关于晶体性质的叙述,哪一条是错误的()?
- A、晶体具有各向异性的性质
- B、有些晶体整体具有各向同性的性质
- C、石英、金属属于晶体结构
- D、晶体的质点排列为近程有序、远程无序
正确答案:D -
第16题:
根据晶体结构理论和化学键理论,试比较下列各组物质熔点的高低。 (1)ZnCl2、CaCl2、KCl三种晶体 (2)NaBr、NaF、NaCl、NaI四种晶体 (3)NaF、KF、MgO、SiCl4、SiBr4五种晶体
正确答案: (1).CaCl2> KCl > ZnCl2
(2).NaF > NaCl > NaBr > NaI
(3).MgO > NaF > KF > SiCl14> SiBr4 -
第17题:
比重法测量密度为0.67g/cm3的油品两次,分别为0.65g/cm3和0.68g/cm3,下列说法不正确的是()。
- A、测量绝对误差分别为-0.02g/cm3和0.01g/cm3
- B、相对误差分别为2.98%和1.49%,由此判断第二次准确度高
- C、相对误差分别为-2.98%和1.49%,由此判断第一次准确度高
正确答案:B -
第18题:
晶体类型相同而化学组成不同的矿物,其相对密度主要取决于()。
- A、所含元素的相对原子质量
- B、所含元素的离子半径
- C、所含元素的原子半径
- D、所含元素的相对原子质量及其原子或离子的半径
正确答案:D -
第19题:
MgO,CaO,SrO,BaO四种氧化物均为NaCl型晶体,在它们的晶体中正离子半径的大小顺序为(),由此可得出晶格能的大小顺序为(),熔点高低顺序为()。
正确答案:Ba2+>Sr2+>Ca2+>Mg2+;MgO>CaO>SrO>BaO;MgO>CaO>SrO>BaO -
第20题:
为使HAc溶液的电离度和溶液的pH都增加,往HAc溶液中加的物质应是下列中哪一种?()
- A、NaAc晶体
- B、NaOH晶体
- C、HCl(g)
- D、NaCl晶体
正确答案:B -
第21题:
关于石英晶体的结构下列说法正确的是()。
- A、石英晶体具有完全各向异性的特性;
- B、石英晶体具有完全各向同性的特性;
- C、石英晶体是介于各向异性和石英晶体具有完全各向异性的晶体;以上说法都不对。
正确答案:C -
第22题:
单选题绝缘栅场效应晶体管根据结构不同分为()AP沟道增强型效应晶体管和N沟道结型场效应晶体管
B增强型绝缘栅场效应晶体管和耗尽型绝缘栅场效应晶体管
CN沟道结型场效应晶体管和P沟道增强型场效应晶体管
DN沟道结型场效应晶体管和P沟道绝缘栅型场效应晶体管
正确答案: B解析: 暂无解析 -
第23题:
问答题用NaCl的晶体结构为例说明鲍林第二法则。正确答案: 鲍林第二法则为“一个稳定的晶体结构中,从所有相邻的阳离子到达一个阴离子的静电键之总强度等于阴离子的电荷”。NaCl结构中,CNCl-=6和CNNa+=6。每个Na+到达1个Cl-的静电强度为1/6,到达1个Cl-的总静电强度为1/6×6=1,与Cl-的电荷数相同。解析: 暂无解析 -
第24题:
填空题在原子量和()或()的情况下,晶体结构越紧密的矿物其相对密度()。正确答案: 离子半径相同,相近,越大解析: 暂无解析
