标准状况下,铁与盐酸发生反应产生44.8升氢气,如果盐酸过量,则参加反应的铁为()g。A、28B、56C、112D、224
题目
标准状况下,铁与盐酸发生反应产生44.8升氢气,如果盐酸过量,则参加反应的铁为()g。
- A、28
- B、56
- C、112
- D、224
相似考题
更多“标准状况下,铁与盐酸发生反应产生44.8升氢气,如果盐酸过量,则”相关问题
-
第1题:
既能跟盐酸,又能跟氢氧化钠反应,产生氢气的物质是( )。
A.铝
B.铁
C.铜
D.氧化铝
正确答案:A
-
第2题:
镁、锌、铁三种金属各30g,分别与足量盐酸反应,生成氢气的质量各是多少?如果反应后各生成氢气30g,则需要这三种金属的质量各是多少?
生成氢气的质量:Mg: 2.5g, Zn: 0.92g, Fe: 1.07g 需要金属的质量:Mg: 360g, Zn: 975g, Fe: 840g -
第3题:
将8.4 g铁粉跟50 mL盐酸充分混合反应后,有固体剩余,同时收集到1.12 L(标准状况下)H2.原盐酸的物质的量浓度为____________mol/L.答案:解析:2 【解题指要】
(1)铁粉与盐酸混合固体有剩余,即铁粉过量.所以根据反应生成H2的体积,可求得盐酸
中HCl的物质的量.
设50 mL盐酸中HCl的物质的量为xmol,则
所以盐酸的物质的量浓度为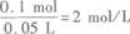

题目已经给出V=0.05 L,所以,只要求得溶质(HCl)的物质的量n代入上式,即可求得c.在
用上式时,应注意V的单位应是“L”,不能用“mL”代入.
(3)Fe与HCl反应的生成物是FeCl2,不是FeCl3.注意不要写错,否则不能得到正确答案. -
第4题:
一、考题回顾

二、考题解析
【教学过程】
环节一:生活导入
【提出问题】厨房用来盛装醋的容器,一般不采用铝制品,原因是什么?
【学生回答】铝制品会与醋酸发生化学反应。
【教师引导】金属与其他酸能否发生反应?
环节二:新课教学
【教师演示实验】镁条与盐酸的反应,检验生成的气体。
【提出问题】镁条与盐酸反应生成的气体是何种气体?
【学生回答】试管口接近酒精灯火焰,能听到清脆的爆鸣声,判断生成的气体是氢气。
【提出问题】铁、锌、铜能否与盐酸发生反应生成氢气,这四种金属与硫酸反应的实验现象是怎样的,反应的化学方程式应该如何书写。
(学生自主实验环节,分别进行镁、锌、铁、铜与盐酸、硫酸的反应,记录发生反应的实验现象,反应的剧烈程度,书写反应的方程式。)
【学生回答,教师总结】
镁、锌、铁都能与盐酸、硫酸反应生成氢气,铜不能与盐酸、硫酸发生反应,书写化学方程式如下:
【提出问题】以小组为单位思考如下的问题:
①哪些金属能与盐酸、稀硫酸发生反应?反应的剧烈程度如何?反应后生成了什么气体?哪些金属不能与盐酸、稀硫酸发生反应?根据反应时是否有氢气产生,将金属分为两类。
②对于能发生的反应,从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?将这一类反应与化合反应、分解反应进行比较。
【学生回答,教师总结】
①镁、锌、铁能与酸发生反应,反应剧烈程度由大到小依次为镁、锌、铁、铜,且镁、铁、锌与酸反应均放出氢气,铜不与酸反应;
②这些反应都属于一种单质和一种化合物反应生成另外一种单质和另外一种化合物的反应。反应类型不同于化合反应、分解反应。
【教师引导】这几个反应都是由一种单质与一种化合物的反应,生成另一种单质和另一种化合物。这种反应叫做置换反应。
【提出问题】通过金属与酸反应实验的探究,你能够得到什么结论?
【学生回答】镁、锌、铁的金属活泼性比铜强,他们能置换出酸中的氢,而反应速度镁大于锌,锌大于铁,所活动性镁大于锌大于铁。
环节三:巩固提高
下列反应属于化合反应、分解反应、置换反应中那种反应类型?。 答案:解析:
答案:解析: -
第5题:
铁与盐酸的反应属于()反应,生成氯化亚铁和氢气。
- A、酸碱中和
- B、盐的水解
- C、沉淀
- D、氧化还原
正确答案:D -
第6题:
镁、铁、铝、铜都能与稀盐酸反应放出氢气。()
正确答案:错误 -
第7题:
关于盐酸的物理化学性质,下面哪一个说法是不正确的()。
- A、盐酸是没有颜色的液体
- B、浓盐酸有白雾是因为从浓盐酸中挥发出来的氯化氢气体与空气中水蒸气接触形成的
- C、盐酸跟很多金属单质反应会产生氢气
- D、浓盐酸中含有质量分数为80%以上的氯化氢
正确答案:D -
第8题:
金属锌与稀盐酸反应产生氢气,是()反应。
- A、化合
- B、置换
- C、分解
- D、复分解
正确答案:B -
第9题:
与铜在加热条件下反应能生成氢气的是()
- A、浓硝酸
- B、浓硫酸
- C、浓盐酸
- D、稀硫酸
正确答案:C -
第10题:
用盐酸与锌反应制取氢气,下列方法能增大反应速率的是( )
- A、增加盐酸的用量
- B、用同浓度的醋酸代替盐酸
- C、用锌粉代替锌粒
- D、增大压强
正确答案:C -
第11题:
在盐酸的催化下,甲醛可与乙醇发生缩合反应。
正确答案:错误 -
第12题:
填空题钠、镁、铝分别与足量的盐酸反应,在相同状况下产生的氢气的体积相等,则钠、镁、铝三种金属的物质的量之比为____.正确答案: 6∶3∶2解析:
三个反应中金属与氢气的对应比例分别为2Na~H2,Mg~H2,2Al~3H2,所以当氢气的量相同时,钠、镁、铝三种金属的物质的量之比=2∶1∶(2/3)=6∶3∶2. -
第13题:
锌与盐酸(HCl)反应生成氢气和氯化锌。实验室里用6.5g锌与足量盐酸反应,可
制得氢气和氯化锌的质量各是多少?
解:设制得H2的质量为x,ZnCl2 的质量为y。 Zn+2HCl=ZnCl2+H2↑ 65 136 2 6.5 g y x x=6.5g×2/65=0.2g y=136×6.5g/65=13.6g 答:可制得H2的质量约为0.2 g,ZnCl2的质量约为13.6 g。 -
第14题:
将0.65g锌全部溶于200 mL稀盐酸中,然后加入80 mL 0.5 mol/L AgNO3溶液,恰好使Cl-沉淀完全。试计算:
(1)产生多少升(标准状况下)氢气。
(2)原稀盐酸的物质的量浓度为多少。答案:解析:
-
第15题:
.6g Na2CO3·10H2O与质量分数为36.5%(密度1.19g/cm3)的盐酸完全反应,消耗这种盐酸溶液多少毫升?在标准状况下,反应答案:解析:
-
第16题:
属于中和反应的是()。
- A、食盐溶于水中
- B、一氧化碳的燃烧
- C、铁与盐酸反应
- D、盐酸与火碱反应
正确答案:D -
第17题:
铁与盐酸的反应属于()反应,它生成氯化亚铁和氢气。
- A、酸碱中和
- B、盐的水解
- C、沉淀
- D、氧化还原
正确答案:D -
第18题:
金属铜不镕于稀盐酸,但在硫脲存在下,铜与浓盐酸反应产生氢气。这是由于生成(),而使铜的()增强的缘故。铜与HI溶液反应生成H2和白色的()沉淀。
正确答案:[Cu(CS(NH2)2)2]+;还原性;CuI -
第19题:
既能跟盐酸,又能跟氢氧化钠反应,产生氢气的物质是()
- A、铝;
- B、铁;
- C、铜;
- D、氧化铝
正确答案:A -
第20题:
铁与盐酸的反应属于()反应,它生成氯化亚铁和氢气。
正确答案:氧化还原 -
第21题:
ⅠB和ⅡB族元素从上到下活泼性依次().只有()能与盐酸反应产生氢气
正确答案:减弱;Zn、Cd -
第22题:
盐酸的危险特性有()。
- A、能与一些活性金属粉末发生反应,放出氢气
- B、遇氰化物能产生剧毒的氰化氢气体
- C、与碱发生中合反应,并放出大量的热
- D、具有较强的腐蚀性
正确答案:A,B,C,D -
第23题:
单选题用盐酸与锌反应制取氢气,下列方法能增大反应速率的是( )A增加盐酸的用量
B用同浓度的醋酸代替盐酸
C用锌粉代替锌粒
D增大压强
正确答案: D解析: 暂无解析
